Le système endomembranaire :
1-Définition : C’est un ensemble de structures qui apparaissent comme des compartiments délimités par une cytomembrane. Ils sont spécifiques des cellules eucaryotes. Ces structures interagissent les unes avec les autres et avec la membrane plasmique, cette interaction est à l’origine de appellation de système endomembranaire . Les compartiments (ou cavités intracellulaires) ont des morphologies différentes, ex : Vésicule,
Tubule, citerne, canalicule (voir les diapositives) et peuvent provenir les uns des autres.
2-Le réticulum endoplasmique : C’est un réseau canaliculaire qui peut être granulaire/rugueux (REG/RER/Ergastoplasme) ou agranulaire/lisse (REL)
1- Origine : Le REG provient de l’enveloppe nucléaire, et le REL provient du REG
2- Topographie cellulaire : Le REG est en continuité avec l’enveloppe nucléaire alors que le REL est en continuité avec le REG
3- Répartition :
• Le REG est majoritaire dans les cellules embryonnaires, mitotiques, nerveuses (dans ce cas les citernes sont étroites et serrées et forment ce qu’on appelle les Corps de Nissl) et les cellules à sécrétions peptidiques (ex : Le pancréas où le REG représente 60% de la surface membranaire)
• Le REL est majoritaire dans les cellules stéroïdes, les adipocytes et les hépatocytes
– Cette répartition dépend de :
-
- Le type d’activité cellulaire : synthèse protéique ou lipidique
- L’état d’activité cellulaire : état d’activité ou de repos, présence ou non de facteurs de détoxification
Remarque : Chez l’hépatocyte le réticulum endoplasmique représente 50% de la surface membranaire totale et 13% du volume cellulaire. En temps normal, le REG est majoritaire, mais dans le cas d’une intoxication aux molécules liposolubles (anesthésiques, benzène …etc) Il y aura production de beaucoup de REL car la cellule va orienter toute son activité vers la détoxification en rendant le médicament hydrosoluble (ajout de fonctions OH) pour le piéger et pouvoir l’éliminer
4- Aspect structural :
- REG : cavités aplaties
- REL : cavités circulaires ou tubulaires
5- Ultrastructure : (MET)
- REG : membrane tristratifiée de 60 A° d’épaisseur avec la face cytosolique garnie de ribosomes et la face luminale lisse
- REL : membrane tristratifiée de 60 A° d’épaisseur avec les deux faces lisses
– Composition chimique : Homogénat —-(3ème UCD)–> Microsomes—(UGD)–> microsomes lisses + microsomes rugueux
– Microsomes lisses (vésicules, tubules du REL, appareil de Golgi, membrane plasmique …Etc) ———(traitement spécifique)—-> Isolement du microsome REL —> Analyse biochimique
– Microsomes rugueux—(détergent)—> Libération des ribosomes —> microsomes lisses provenant initialement du REG > Analyse biochimique
– Contenu des membranes :
– Glucides : du coté luminal et en faible quantité (responsable de la différence d’épaisseur avec la membrane plasmique)
– Lipides : riche en phospholipides à acides gras insaturés, peu de cholestérol et présence d’un phospholipide spécifique au réticulum endoplasmique : Le Dolichol => La membrane est très fluide
– Protéines structurales :
- Récepteur de la SRP (R-SRP) : la SRP (signal recognition particule) est une particule ribonucléoprotéique cytosolique à activité GTPasique
- Translocon : protéine de type canal, récepteur de la grande sous-unité ribosomique
- Chapronnes (BIP : Binding protéine) : Protéine d’accompagnement
– Protéines enzymatiques : N-Glycosyl-Transférase, C-Glycosyl-Transférase, glycosidases, PDI, peptidases du signal, cytochrome P450 (spécifique au REL), Pompe Ca2+ (spécifique au REL), canaux de libération de Ca2+ IP3 dépendant (spécifique au REL), Calsequestrine (spécifique au REL).
6- Fonctions du REG :
¬ synthèse protéique et modifications co- et post- traductionnelles
¬ Translocation et élongation des protéines solubles dans la lumière et des protéines membranaires dans la membrane
Les modifications co-traductionnelles : N- et C-glycosylations, repliements et mise en place des ponts S-S
Les modifications post-traductionnelles : Vérification des ponts S-S, acquisition de la configuration en 3D et contrôle de qualité
– Mécanisme de translocation et d’élongation :
- Cas des protéines solubles :
- synthèse d’un peptide signal (hydrophobe) de 20 Acides aminés
- Echange du GDP par du GTP par la SRP qui va récupérer le peptide signal, il y a arrêt de la traduction et transfert du complexe SRP-polysome sur le REG
- Le récepteur fixe la SRP et il y a ouverture du Translocon (qui était auparavant fermé par des BIP)
- Reprise de la traduction, la chaine peptidique s’allonge et est tirée par des BIP
- Diminution de l’affinité entre la SRP et le peptide signal, il y a alors hydrolyse du GTP par la SRP et le récepteur => la SRP est recyclée et le récepteur s’éloigne par diffusion latérale
- La peptidase du signal coupe le peptide signal de la chaine polypeptidique, Il y a libération du polypeptide. La protéine est soluble dans la lumière. Elle est ou destinée à l’exportation ou une hydrolase acide.
- Cas des protéines membranaires : Apparition des séquences hydrophobes : Séquences de début et séquences d’arrêt (domaine trans- membranaire de la protéine) La peptidase du signal élimine les séquences de début.
– Repliement des protéines : Le repliement des protéines au cours de l’élongation est assuré par des BIP de repliement, le but de ce repliement est :
-
- Dégager les séquences qui vont servir à la glycosylation
- Mettre en place les ponts S-S de façon aléatoire
– Mécanisme de Glycosylation :
-
- La N-glycosylation : la chaine sucrée est fixée au N de l’Asparagine (Asn) en présence de la séquence consensus (séquence signal) : Asn – X – Ser, Asn – X – Thr
- La C-glycosylation : la chaine sucrée est fixée au C du Trp, présence de la séquence Trp – X – X – Trp
– Construction dans le cytosol d’une chaine sucrée = oligosaccharide de 14 sucres ( N-acétyle- glucosamine x2 – Mannose x9 – Glucose x3)
– l’UDP transporte le glucose et le N-acétyle-glucosamine. Le GDP transporte les mannoses vers la membrane du REG
– Accrochage de la chaine au Dolichol qui sera double phosphorylé
– Mouvement de Flip-Flop => translocation vers la lumière du REG
– La glycosyl-transférase déplace la chaine sucrée du Dolichol vers le polypeptide
– Elagage de la chaine sucrée par coupure des 3 glucoses et d’un mannose par des glycosidases
Remarque : Le repliement et la glycosylation sont concomitants
– Vérification des Ponts S-S : La PDI procède à la vérification des ponts S-S en maintenant ceux au bon endroit et en clivant les
mauvais pour les remplacer par d’autres aux bons endroits. => Cette vérification permet l’acquisition de la conformation en 3D finale de la protéine. – Contrôle de qualité : La protéine subit un contrôle de qualité final (assuré par les interactions avec les BIP’s, la réaction au pH …Etc)
-
- Contrôle positif : bourgeonnement en vésicules de transition
- Contrôle négatif : sortie à travers le Translocon et dégradation dans le Protéasome (Complexe protéique cytosolique qui assure la dégradation des protéines mal conformées ou en fin de vie)
Remarques :
- Rôles des BIP : repliement, fermeture du Translocon, séquestration du Ca2+
- Résultats de l’activité du REG :
- Synthèse des protéines destinées à l’exportation ou les hydrolases acides
- Synthèse des protéines périphériques externes et internes et trans-membranaires de la membrane plasmique et du sytème endomembranaire
7- Fonctions du REL :
-
- Synthèse des phospholipides membranaires
- Synthèse des hormones stéroïdes
- Stockage du Ca2+
- Détoxification
3-L’appareil de Golgi :
Il désigne l’ensemble des Dictyosomes d’une cellule (2 à 20 par cellule), le Dictyosome est formé par un empilement de 4 à 10 saccules maintenus en place par des microtubules, le saccule est lui même formé de la fusion de vésicules issues du réticulum endoplasmique.
1-Observation : L’appareil de Golgi peut être observé au MET, MEB et microscope photonique
2-Localisation cellulaire : Elle varie en fonction de la morphologie de la cellule et de l’activité cellulaire, Il peut être supra- nucléaire (Cellule granulaire) ou péri-nucléaire (cellule nerveuse)
3-Analyse chimique : (par centrifugation à faible vitesse) , Les membranes contiennent des protéines, beaucoup de glucides et 35% de lipides (taux intermédiaire entre la membrane plasmique et la membrane du réticulum endoplasmique, la fluidité est aussi intermédiaire)
4-Ultrastructure : Le Dictyosome possède une polarité fonctionnelle :
-
- Le CGN (Cis-Golgi-Network) : Face d’entrée Formé par la fusion de vésicules provenant du compartiment de communication ERGIC (RE-Golgi-Intermédiaire- Compartiment)
-
- Le saccule Cis : membrane de 60 A°
- Les saccules médians
- Le saccule Trans : membrane de 75 A°
– Ces trois derniers sont des compartiments clos avec une lumière dilatée latéralement qui va former des vésicules latérales : vésicules de transport
-
- Le TGN (Trans-Golgi-Network) : Face de sortie ; Forme les vésicules de sécrétion ou même des tubules comme pour la vacuole autophagique (voir les diapositives)
5-Fonctions : Le Dictyosome a un rôle d’étiquetage, c’est à dire de relais qui va déterminer le devenir de chaque protéine en apportant des modifications post-traductionnelles :
5-1- Tri : Caractérisation des protéines par addition ou élimination de groupements. Ce tri est spécifique à chaque saccule en raison de la spécificité des enzymes :
¬ Cis : Phosphorylation du mannose en position C6 => futures hydrolases acides. En deux étapes :
-
- N-Acétyle-glucosamine-phosphate (Glc-Nac-P) est accroché au C6 des mannoses par la Glc-Nac-P-transférase => séquence signal de phosphorylation
- La Glc-Nac-P-glucosidase libère le N-Acétyle-glucosamine, par la suite les hydrolases acides sont transportées vers le saccule Trans où elles seront reconnues par le récepteur du Mannose-6-P, il y aura bourgeonnement et adressage vers le compartiment endosomal ou la vacuole autophagique, ensuite le phosphate est éliminé => Hydrolase mature
¬ Saccules Médians :
-Elimination du mannose par une mannosidase
-O-Glycosylation : Elle concerne aussi bien les protéines solubles que transmembranaires dans leur domaine luminal, les oses sont ajoutés un par un :
-
- Les sucres accrochés à l’UDP pénètrent dans le saccule par une perméase anti-port (fait rentrer le sucre et fait sortir l’UMP)
- Découplage du sucre avec l’UDP à cause du pH puis déphosphorylation de l’UDP en UMP + Pi par la Nucléoside di-phosphatase
- La O-Glycosyl-transférase accroche le sucre sur l’oxygène du Ser ou du Thr
=> Ceci correspond à une maturation de la protéine N-glycosylée
Remarques :
– les sucres peuvent être : Galactose, Acide sialique, N-Acétyle-glucosamine et N-Acétyle- galactosamine
– Les enzymes de la O-Glycosylation sont toutes transmembranaires
¬ Trans :
-O-Glycosylation plus importante que dans les saccules médians
-Sulfatation : Elle concerne les compostants de la matrice extracellulaire comme les glycoprotéines, les GAG, les protéoglycanes …Etc. Etapes :
-
- Formation cytosolique du donneur de sulfate : le PAPS
- Translocation vers le saccule Trans par une translocase
- Libération du groupement sulfate : PAPS > PAP + SO42-
- La sulfo-transférase accroche le SO 2- sur des oses ou sur des acides aminés : Tyr (principalement), Ser, Thr
¬ TGN et vésicules de sécrétions :
-Clivage protéolytique : pour avoir une maturation fonctionnelle des chaines qui vont former des hormones, neuro-hormones, enzymes …etc. (voir les diapositives)
5-2-Emballage : Il s’agit de définir sous quelle forme la protéine doit sortir du saccule :
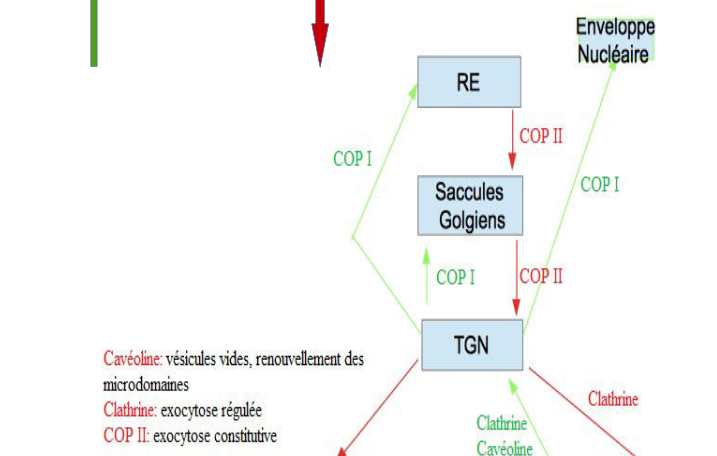
-
- Vésicules de transition : REG => CGN
- Vésicules de transport : Cis => Médian et Médian => Trans et Trans => TGN
- Vésicules de sécrétion : TGN => Membrane plasmique et TGN => Endosome
5-3-Adressage : Détermination de la destination de la protéine. L’adressage est assuré par :
-
- Des revêtements membranaires spécifiques : Clathrine, Cavéoline, Coatomères (COP I et COP II)
- Des protéines trans-membranaires pour la reconnaissance entre compartiments : V.Snars et T.Snars (voir l’explication de l’enseignante ainsi que les diapositives)
– Le transport des protéines constitue des flux membranaires vectoriels permanents bidirectionnels : Chaque compartiment est à la fois donneur et receveur
Remarque : L’emballage + l’adressage constituent le moyen de communication entre les compartiments du système endomembranaire
Remarques :
-
- Le flux de retour se fait par des tubules et non par des vésicules
- Il existe une séquence dans la protéine qui détermine le type de revêtement et les Snars, et donc la destination. Ex : La séquence KDEL pour les protéines du réticulum endoplasmique
- Il existe des T.Snars et des V.Snars même pour l’adressage à la membrane plasmique
- Flux centrifuge : recyclage des récepteurs, renouvellement de la matrice extracellulaire et des rafts, exocytose
- Flux centripète : renouvellement des composants du système endomembranaire, recyclage des récepteurs M6P, endocytose